, Grit Ulrike Tautenhahn3 und Thilo Oliver Kromer1
(1)
Fakultät für Therapiewissenschaften, SRH Hochschule Heidelberg, 69123 Heidelberg, Deutschland
(2)
Department of Epidemiology, Maastricht University, P.O. Box 616, 6200 MD Maastricht, Niederlande
(3)
87435 Kempten, Deutschland
Zusammenfassung
In diesem Kapitel werden grundlegende Sichtweisen und Themen dargestellt – die zunehmend geforderte evidenzbasierte Praxis, die Grundlagen der ICF, ein Überblick über die pathobiologischen Mechanismen sowie eine Einführung in den Clinical Reasoning-Prozess – die in die physiotherapeutische Befundaufnahme und Behandlung, die jeweils in den weiteren Kapiteln beschrieben werden, miteinfließen. Die einzelnen Themen sind jeweils sehr komplex, so dass in diesem Kapitel nur ein grundlegender Einblick gegeben werden kann und eine Vertiefung empfohlen wird. Die hier aufgeführten Grundlagen sind jedoch sehr praxisbezogen und können wesentlich dazu beitragen, die „Expertise“ des Therapeuten zu fördern und die Behandlungsergebnisse zu optimieren.
In diesem Kapitel werden grundlegende Sichtweisen und Themen dargestellt – die zunehmend geforderte evidenzbasierte Praxis, die Grundlagen der ICF, ein Überblick über die pathobiologischen Mechanismen sowie eine Einführung in den Clinical Reasoning-Prozess – die in die physiotherapeutische Befundaufnahme und Behandlung, die jeweils in den weiteren Kapiteln beschrieben werden, miteinfließen. Die einzelnen Themen sind jeweils sehr komplex, so dass in diesem Kapitel nur ein grundlegender Einblick gegeben werden kann und eine Vertiefung empfohlen wird. Die hier aufgeführten Grundlagen sind jedoch sehr praxisbezogen und können wesentlich dazu beitragen, die „Expertise“ des Therapeuten zu fördern und die Behandlungsergebnisse zu optimieren.
2.1 Evidenzbasierte Praxis : Von der Philosophie zur klinischen Praxis
Rob A. de Bie
2.1.1 Evidenzbasierte Medizin : Definition
Evidenzbasierte Medizin (EbM)1 und ihre Protagonisten,
randomisierte kontrollierte Studien,
systematische Übersichtsarbeiten (engl. „systematic reviews“) und
Leitlinien,
liegen derzeit im Trend und werden als Allheilmittel für eine bessere Gesundheitsversorgung betrachtet. Krankenversicherungsgesellschaften, Gesundheitsminister, Allgemeinärzte, Spezialisten und andere im Gesundheitsbereich Tätige interessieren sich für Evidenz mit dem Ziel einer besseren Gesundheitsversorgung. Und zu guter Letzt beginnen nun auch die Patienten, evidenzbasierte Behandlungsstrategien zu fordern. Scheinbar gibt es keine Gesundheitsversorgung mehr ohne Evidenz. Zum aktuellen Zeitpunkt ist es jedoch so, dass eine Evidenz weitaus häufiger fehlt als dass sie vorhanden wäre. Und selbst wenn Evidenz vorhanden ist, führt sie nicht automatisch zu einer besseren Gesundheitsversorgung.
Die Ursprünge der evidenzbasierten Medizin reichen bis in das nachrevolutionäre Paris im Jahr 1850 zurück. Zu diesem Zeitpunkt begann man nach und nach, Aussagen von Autoritäten anzuzweifeln und stattdessen Behandlungsstrategien auf systematischen Beobachtungen der Patienten zu begründen. Um 1992 wurden die Ideen der evidenzbasierten Medizin an der McMaster Universität in Kanada „neu erfunden“. In einem Leitartikel gaben David Sackett et al. (1996) die erste moderne Definition der EbM: die gewissenhafte, explizite und überlegte Anwendung der aktuell besten Evidenz bei Entscheidungen im Zusammenhang mit der Versorgung einzelner Patienten. In der 1. Auflage ihres Buches definierten Sackett et al. (1997) die EbM detaillierter: EbM ist der Prozess eines lebenslangen selbstbestimmten Lernens, bei dem die Versorgung der Patienten einen Bedarf an klinisch relevanten Informationen über Diagnose, Prognose, Therapie und andere klinische und gesundheitsrelevante Aspekte schafft. Kritiker der EbM behaupten gerne, dass die evidenzbasierte Medizin nichts anderes sei als alter französischer Wein in neuen kanadischen Flaschen, und dass die Art und Weise, wie Sackett et al. die EbM verfechten, eigentlich eine autoritäre Aussage an sich darstelle, die auf unangemessene Weise die Debatte über die EbM polarisiere (Sehon u. Stanley 2003).
Wichtig
Derzeit bezeichnet EbM das Integrieren der besten Forschungsevidenz mit klinischer Expertise sowie die Berücksichtigung der Wertvorstellungen von Patienten, die in der realen Welt eingebettet sind.
Die schnelle Verbreitung der EbM ist auf 4 häufig zitierte Faktoren zurückzuführen:
die alltägliche Notwendigkeit adäquater und valider Informationen über Diagnose, Behandlung, Prognose und Prävention,
die Unzulänglichkeit traditioneller Informationsquellen (z. B. Lehrbücher, Experten),
die Diskrepanz zwischen klinischen Fertigkeiten und der Fähigkeit, mit dem Wissen auf dem Laufenden zu bleiben,
die Unfähigkeit, genug Zeit für die Aktualisierung des Wissens mithilfe von traditionellen Quellen aufbringen zu können.
Andere Faktoren, die diesen Prozess beschleunigt haben, sind zum einen die Patienten, die immer mehr Forderungen stellen, wenn sie mit Fragen über ihre eigene Gesundheit konfrontiert werden, sowie zum anderen der wachsende Druck von Regierungsseite, Politikern und Versicherungsgesellschaften, die aggressiv eine Kosteneffektivität einfordern.
2.1.2 Evidenzquellen
◘ Abbildung 2.1 stellt die Rolle der Evidenz bei der Behandlung einer beliebigen Krankheit dar. Die erfolgreiche Behandlung einer Krankheit hängt nicht nur von der Evidenz für die beste Behandlung ab, sondern auch davon, wie viel Geld für eine Therapie (Behandlungskosten) ausgegeben werden kann, sowie von der Verfügbarkeit an Sachmitteln (verfügbare Ressourcen). Der dritte wesentliche Faktor besteht in unseren gesellschaftlichen Werten, unseren Überzeugungen und Zweifeln in Verbindung mit Krankheit und Gesundheit.
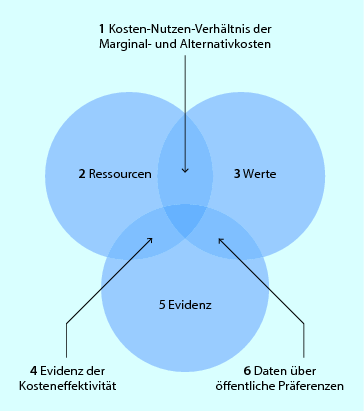
Abb. 2.1
EBM-Modell. Schematische Darstellung der Relation von Evidenz, Ressourcen und Werten. 1 Kosten-Nutzen-Verhältnis der Marginal- und Alternativkosten. 2 Ressourcen. 3 Werte. 4 Evidenz der Kosteneffektivität. 5 Evidenz. 6 Daten über öffentliche Präferenzen
Eine der EbM ähnliche Forschungsrichtung, die zunehmend an Popularität gewinnt, ist die systematische Übersichtsarbeit. In diesem Zusammenhang ist insbesondere die statistische Variante, die sog. zusammengefasste („pooled“) Metaanalyse äußerst beliebt. Systematische Übersichtsarbeiten können Antworten geben – zusammengefasste Antworten, und zwar nicht nur zur Therapie, sondern auch zu Diagnose, Prognose und Kosteneffektivität.
Obwohl systematische Übersichtsarbeiten in bestimmten Bereichen für eine transparente und standardisierte Analyse der Forschungsevidenz sorgen, muss doch deutlich gemacht werden, dass die Methodologie der systematischen Übersichtsarbeiten noch immer eher experimentell ist und im Prozess der Überprüfung (engl. „reviewing“) – obgleich standardisiert – noch viel Spielraum für eine ganze Reihe von subjektiven Ermessensentscheidungen bleibt. Darüber hinaus fehlen in zahlreichen Bereichen gute Studien, so dass es ohne Evidenz sehr schwer ist, eine systematische Übersichtsarbeit zu entwerfen.
In der Praxis müssen bei Anwendung der „besten“ Evidenz mehrere Schritte berücksichtigt werden:
Eine klare klinische Frage für ein Patientenproblem formulieren.
Nach relevanten Quellen suchen (z. B. Literatur, Datenbanken).
Material bezüglich Validität und Nützlichkeit kritisch bewerten.
Ergebnisse in der Praxis implementieren.
Auswirkungen evaluieren.
Wichtig
Evidenzbasierte Medizin beginnt mit der Formulierung von Fragen . Die Fragen können allgemein formuliert (hintergründig), aber auch auf den Patienten bezogen (vordergründig) sein.
Beispiel
Patientenbezogen könnte man fragen: Ist bei Patient X mit seinen Schmerzen im unteren Rückenbereich eine Übungstherapie effektiv, wobei die Übung als Dehnübung, die Schmerzen als rezidivierende Kreuzschmerzen und der Patient als 55-jähriger Schreiner definiert werden.
Je spezifischer die Frage ist, desto einfacher kann es sein – zumindest aus theoretischer Perspektive – eine Evidenz für oder gegen die Therapie zu finden, für die man sich interessiert.
Die meisten Mitarbeiter der Gesundheitsberufe sind mit klinischen Fragen sehr vertraut, sehr viel schwieriger gestaltet sich jedoch das Herausfinden einer geeigneten Evidenz (Literatur). Wo findet man in einem zeitlich angemessenen Rahmen relevante Literatur? Niemand möchte mit seiner Frage in die Bibliothek gehen, dort 3 Wochen campieren und dann erst mit dem benötigten Material wieder herauskommen. Damit eine evidenzbasierte Praxis machbar ist, sollten verlässliche Informationsquellen einfach und schnell zur Verfügung stehen. Und obwohl elektronische Literatursuchsysteme einen schnellen Zugang zu relevanter Literatur ermöglichen, ist das Herausfiltern der wesentlichen Informationen, die im speziellen Fall benötigt werden, ein wissenschaftliches Unterfangen an sich, für das die meisten Mitarbeiter im Gesundheitsbereich nicht ausgebildet sind.
In den meisten Fällen ist man in der Praxis aufgrund dessen, dass keine Bibliothek vorhanden ist, versucht, einen älteren Kollegen zu befragen oder noch besser gleich zwei. Aber was ist, wenn sie nicht einer Meinung sind, oder wenn sie auf ein Lehrbuch verweisen, das bei genauerem Hinsehen aus den 1990er Jahren stammt. Im Zusammenhang mit der EbM-Bewegung trifft David Sackett die kühne Aussage: „Verbrennen Sie Ihre Lehrbücher!“ Er verdeutlicht seinen Standpunkt mit folgendem Zitat:
Wenn die Seiten des Lehrbuches nach verwesendem Müll riechen, da sie veraltet sind, können die nicht stinkenden Teile immer noch nützlich sein, weil Lehrbücher im Allgemeinen für die klinische Anwendung gut organisiert sind und ein Großteil ihres Inhaltes zu jedem Zeitpunkt aktuell sein wird. Leider ist es jedoch unmöglich festzustellen, was noch „up to date“ ist und was nicht. (Sackett et al. 1997)
Noch schlimmer ist, dass es viel Zeit in Anspruch nimmt, ein Lehrbuch herauszugeben (manchmal bis zu 10 Jahren). Demzufolge ist es nicht weiter überraschend, dass einige Werke schon nicht mehr aktuell sind, wenn sie auf den Markt kommen.
Man könnte auch das Internet nutzen, z. B. Medline (www.ncbi.nlm.nih.gov), Scholar (scholar.google.country) oder PEDro (Datenbank mit ausschließlich physiotherapeutischem Material wie randomisierte kontrollierte Studien, Übersichtsarbeiten und Leitlinien; www.pedro.org.au) googeln. Diese Quellen sind jedoch nicht vergleichbar (z. B. weit gefasste allgemeine Gesundheitsperspektiven vs. hoch spezialisierte Perspektiven), zeigen nur Abstracts an, und man muss dann immer noch warten, bis der volle Text eines Artikels ausgedruckt geschickt wird.
Die Cochrane Collaboration versucht einen Teil dieses Problems zu lösen, indem systematische Übersichtsarbeiten über die Auswirkungen der Gesundheitsversorgung vorbereitet, gesammelt und verbreitet werden (www.cochrane.org). Als Mitarbeiter im Gesundheitsbereich muss man nicht jede einzelne Studie lesen, sondern kann die zusammengefassten Ergebnisse durchgehen. Doch das Lesen von systematischen Übersichtsarbeiten sowie anderer Formen von Evidenz erfordert bestimmte Fähigkeiten. Damit man versteht, welche Entwicklungen in der eigenen Profession stattfinden, muss man die Evidenz verstehen können. Und da die Literatur in unterschiedlichen Formaten vorliegen kann, z. B. Artikel, Bücher, Forschungsentwürfe, Abstracts oder Konferenzpräsentationen, werden für jedes Format andere Fähigkeiten benötigt. Man sollte in der Lage sein, die Literatur kritisch zu bewerten, auch wenn es nur darum geht, professionell betrachtet auf dem Laufenden zu bleiben.
Leitlinien
Eine wertvolle dritte Quelle der Evidenz sind Leitlinien, die heute weltweit im internationalen Leitliniennetzwerk (Guidelines International Network; www.g-i-n.net) Zustimmung finden.
Eine Leitlinie ist eine systematisch entwickelte Aussage, die Ärzten und Patienten hilft, Entscheidungen über die geeignete Behandlung einer bestimmten Erkrankung zu treffen. Leider erfordert auch das Lesen und Verwenden von Leitlinien bestimmte Fähigkeiten.
Bei der Anwendung einer Leitlinie kann eine ganze Reihe von Fragestellungen hilfreich sein. Da eine Leitlinie den Verlauf einer Krankheit meist ganz allgemein betrachtet, von einem therapeutischen Startpunkt (Beginn der Therapie) bis zum Ende der Behandlung (Therapie des Patienten wird beendet), stellt sich die Frage, inwieweit eine Leitlinie wirklich evidenzbasiert ist. Manche Leitlinien ähneln bei genauerem Hinsehen eher einer Konsensaussage von Experten als systematischen und wissenschaftlichen Aussagen. In diesem Fall werden Leitlinien zu Leitlügen.
Manchmal gibt es in einem bestimmten Bereich auch mehr als eine Leitlinie, z. B. bei Schmerzen im unteren Rückenbereich. Was, wenn sich diese Leitlinien unterscheiden (was sie tatsächlich auch tun)? Und was, wenn man feststellt, dass diese Leitlinie keine Richtung weist, sondern nur ein schlechter Ersatz für eine Kochbuchmedizin ist?
Um die Sache noch schlimmer zu machen, zeigen aktuelle Forschungsarbeiten, dass nur wenige Leitlinien tatsächlich weder zu einer Veränderung der Verhaltensweisen der behandelnden Anbieter noch zu einer verbesserten Gesundheit des Patienten oder einer besseren Gesundheitsversorgung im Allgemeinen führen. Insbesondere in Behandlungseinrichtungen, in denen nur eine Disziplin vertreten ist und die Anbieter bei Unsicherheiten schnell auf alte Traditionen zurückgreifen, sind Leitlinien häufig nicht effizient (Timmermans u. Mauck 2005).
Als letztes Phänomen sei festgestellt, dass Leitlinien insbesondere bei älteren und chronisch kranken Menschen nicht auf bestehende Begleiterkrankungen eingehen, was u. U. die Behandlung behindern kann. Begleiterkrankungen treten in der allgemeinen Praxis sehr oft auf. Trotz der Unterstützung, die krankheitsspezifische Leitlinien geben, werden sie wahrscheinlich mehr Probleme bringen als lösen, wenn sie bei Patienten mit zusätzlichen Begleiterkrankungen eingesetzt werden. Die Behandlung oder selbst die Diagnose einer Krankheit kann die Behandlung oder den natürlichen Verlauf einer Begleiterkrankung negativ beeinflussen.
Beispiel
Bei einer chronisch obstruktiven Lungenerkrankung (COPD) gehören orale Kortikosteroide zu einer dem neuesten Stand entsprechenden Behandlung; wenn ein Patient jedoch zusätzlich unter Diabetes mellitus leidet, sind orale Kortikosteriode nicht die beste Behandlungsoption. Die Förderung von körperlicher Aktivität – was auch bei chronisch obstruktiver Lungenerkrankung vorteilhaft sein kann – ist vielleicht nicht möglich, weil eine starke Arthrose der Hüfte besteht. Im Gegenzug kann ein Hüftgelenkersatz, der bei starker Arthrose indiziert ist, bei einem Patienten kontraindiziert sein, wenn seine Lungenfunktion eine Vollnarkose ausschließt.
Diese Beispiele zeigen, warum das Befolgen einer Leitlinie, die für eine einzelne Krankheit konzipiert ist, in Fällen mit mehreren chronischen Krankheiten u. U. nicht zu optimalen Gesundheitsresultaten führt. Dadurch wird die erfolgreiche Implementierung von Leitlinien in großem Ausmaß behindert, selbst wenn sie weitgehend evidenzbasiert sind.
Theoretisch ist die Implementierung ein Prozess der systematischen Verteilung und Durchführung von Veränderungen und neuen Maßnahmen in der Gesundheitsversorgung, und zwar auf eine Art und Weise, dass sie Teil der täglichen Routine wird und nicht mehr als neu oder revolutionär betrachtet wird (Barnhoorn 1994).
Aber selbst Leitlinien, die eine optimale Qualität aufweisen und leicht in die Praxis zu integrieren sind, garantieren keine positiven Gesundheitsveränderungen beim Patienten. Experten der Implementierung sehen sich mit einer Übersichtsarbeiten von Grol und Grimshaw (2003) konfrontiert, in der die Schlussfolgerung gezogen wird, dass es immer noch unsicher ist, welche Implementationsstrategien erfolgreich sind, was bis heute leider immer noch zutrifft.
Alles in allem scheint es hier kein wirkliches Entkommen zu geben. Ja, es gibt eine verfügbare (manchmal eingeschränkte) Evidenz, aber diese konkret fassen zu wollen, ist teilweise schwer, und zu verstehen, was damit gemeint ist, kann sich als noch komplizierter erweisen. Offensichtlich müssen professionelle Mitarbeiter im Gesundheitsbereich entsprechend ausgebildet werden, um aus einem wissenschaftlichen Blickwinkel mit der Evidenz umgehen zu lernen, damit sie in ihrer Profession „up to date“ bleiben können. Darüber hinaus müssen sie ihre klinische Perspektive beibehalten und realisieren, dass die Forschungsevidenz nur eine Komponente von medizinischen Entscheidungen ist. Was die EbM von anderen Ansätzen unterscheidet, ist die Tatsache, dass sie bestimmten Evidenzformen Priorität einräumt.
Wichtig
Entsprechend der EbM stammt die beste Form der Evidenz aus randomisierten kontrollierten Studien (RkS, einschließlich systematischen Übersichtsarbeiten) sowie Metaanalysen von RkS.
Diese verstehen und in spezifischen Patientensituationen anwenden zu lernen, erfordert Zeit und Mühe.
2.1.3 Die Hierarchie der Evidenz
Im Bereich der EbM strebt man an, die beste Evidenz zu finden. Je nach Thema, z. B. Diagnose, Therapie oder Prognose, werden Studiendesigns mit höchster methodologischer Qualität am positivsten bewertet. Bei der Bewertung der Effektivität von Eingriffen beispielsweise wird die randomisierte kontrollierte Studie als Goldstandard betrachtet. Dieser Ansatz hat jedoch seine Grenzen: Bei manchen Krankheiten sind z. B. zu wenige Patienten vorhanden, um eine Studie mit ausreichender Aussagekraft durchzuführen, die eine sinnvolle Schlussfolgerung erlauben würde. Ein zweiter Faktor besteht darin, dass bei komplexen Kombinationsbehandlungen (die eine Stärke der physiotherapeutischen Behandlung zu sein scheinen) eine RkS nicht die erste Wahl ist, weil sie den Basisprinzipien einer RkS widerspricht, nämlich der Standardisierung. In einigen Fällen ist es drittens schlichtweg unmoralisch, Studien durchzuführen, während – als vierter Aspekt – in anderen Fällen die frühere Krankheitsgeschichte des Patienten u. U. mehr Einfluss auf das Ergebnis nimmt als die Behandlung selbst.
2.1.4 Wissenschaft versus Praxis
Selbst wenn gute und wissenschaftlich fundierte Studien zur Verfügung stehen, kann die Evidenz in der klinischen Praxis trotzdem unbrauchbar sein. Beispielsweise sind etliche Studien über die Effektivität einer Therapie mit Gehübungen bei Patienten mit symptomatischer peripherer arterieller Verschlusskrankheit (pAVK) durchgeführt worden. Durchschnittlich konnte eine Verbesserung der Gehdistanz bei etwa 195 % gefunden werden (Kruidenier et al. 2012)! Dieser Erfolg bezieht sich jedoch nur auf Personen, die ausschließlich unter einer symptomatischen pAVK leiden, und nicht auf solche, die darüber hinaus eine Begleiterkrankung wie COPD oder Arthrose aufweisen. Es ist wirklich entmutigend, wenn man weiß, dass nur 10 % der Patienten mit symptomatischer pAVK keine Begleiterkrankung haben, was impliziert, dass die Forschungsergebnisse für 90 % der pAVK-Patienten keine Gültigkeit haben.
Wichtig
Um eine tatsächlich evidenzbasierte Medizin zu praktizieren, muss man die Variationen der Patienten(-untergruppen) und ihrer jeweiligen Prognose verstehen.
2.1.5 Steht die EbM im Widerspruch zu professioneller Autonomie?
Evidenzbasierte Leitlinien stehen nur in Themenbereichen zur Verfügung, die in der (Forschungs-)Praxis häufig vorkommen. Dies ist nicht weiter überraschend, wenn man berücksichtigt, dass eine ausreichende Anzahl an Patienten erforderlich ist, um bestimmte Muster in Krankheiten, Diagnosen und Prognosen zu verstehen. Zudem führen Wissenschaftler Studien nur in Patientengruppen durch, die sehr groß sind.
Somit tauchen die wirklich interessanten Fälle im Allgemeinen nicht in Leitlinien auf, da sie nur selten auftreten, dies gilt auch für komplizierte Fälle (siehe obiges Beispiel über die symptomatische pAVK). So erhält der Kliniker den Eindruck, dass Leitlinien nur für einfache Fälle zur Verfügung stehen, bei denen keine Begleiterkrankungen vorliegen. Einige Fachleute behaupten sogar, dass eine solche Anwendung von Leitlinien diese auf das Praktizieren einer Kochbuchmedizin reduziere. Damit bestärken sie sich in ihrer Überzeugung, es selbst am besten zu wissen, weil aus evidenzbasierten Leitlinien oder anderen evidenzbasierten Arbeiten keine Anleitungen zu ziehen sind.
Zudem schrecken auch die Kosten für das Umsetzen einer EbM in der Praxis: Evidenz zu prüfen und anzupassen braucht Zeit; Zeit, die nach Meinung der meisten Kliniker auch zur Behandlung der Patienten (und somit zum Geldverdienen) genutzt werden könnte.
Leitlinien geben jedoch, auch wenn sie nicht direkt auf Patienten anwendbar sind, eine Richtung vor. Sie helfen bei der Rationalisierung von Auswahlmöglichkeiten, optimieren die Anwendung von wissenschaftlichen Kenntnissen, wo sie vorhanden sind, und helfen beim methodologischen Vorgehen – was als Clinical Reasoning2 bekannt ist.
Wichtig
Der richtige Einsatz von EbM bedeutet ein adäquates Ausbalancieren von Evidenz, klinischer Expertise und Patientenpräferenzen – was eine Feinabstimmung der Behandlungsoptionen durch einen kompetenten Therapeuten erfordert.
2.1.6 Die Zukunft der EbM
Betrachtet man die zahlreichen Gesundheitsprobleme, die noch beantwortet werden müssen, ist die Forderung nach neuer Evidenz immer noch gültig und wird es noch lange bleiben. Wenn es den Forschern jedoch nicht gelingt, die Evidenz oder den Zugang zur Evidenz für Kliniker auf angemessene Weise zu integrieren, wird ein Großteil der gesammelten Evidenz auf akademischem Niveau bleiben und niemals den Klinikern und letztlich dem Patienten zugutekommen. Sowohl die Forscher als auch professionelle Organisationen müssen entsprechende Schritte unternehmen, um zu gewährleisten, dass Forschungsinformationen leicht verfügbar sind und sich auf einem Niveau befinden, das für Kliniker und Patienten leicht verständlich ist.
Darüber hinaus sollte die Sammlung neuer Evidenz mehr durch klinische Forschungsfragen als durch wissenschaftliche Fragen geleitet werden. Nicht die Methodologie, sondern das klinische Problem sollte maßgeblich sein. Weitere Literatur über dieses Thema ist in der Beschreibung des Koordinationsmodells (Vos et al. 2004) zu finden, das von drei Schlüsselbereichen mit jeweils eigener Logik und Rationalität sowie eigenen Werten ausgeht, die aufeinander abgestimmt und angepasst werden müssen. Diese Bereiche sind
die Welt der Wissenschaft,
der Bereich der professionellen Betreuungspersonen und
der Bereich der Patienten.
Eine sorgfältige Abstimmung dieser drei Bereiche führt möglicherweise zur bestmöglichen Form von EbM.
2.2 Die Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit
Thilo O. Kromer
2.2.1 Grundkonzepte des bio-psycho-sozialen Modell s
Die Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit (International Classification of Functioning, Disability and Health, ICF ) der Weltgesundheitsorganisation (WHO) hat 2001 die ICIDH abgelöst und ist folgend auch in einer deutschen Fassung erschienen (WHO 2005). Eingesetzt wird die ICF überwiegend in den Bereichen der Rehabilitation und des Behindertenwesens; sie wird auf der Grundlage angewendet, dass eine Gesundheitsstörung im Sinne der ICD vorliegt.
Die ICF benennt und systematisiert Bereiche, Handlungsansätze und Sichtweisen, die die Therapeuten bisher meist nur intuitiv eingeordnet und praktiziert haben. Auch wenn einige Aspekte dieses Systems zunächst befremdlich und gewöhnungsbedürftig sein mögen und Teile des Konzepts noch nicht ausgereift sind, ist die ICF dennoch ein Hilfsmittel, um die Fähigkeiten und Einschränkungen, die eine Person in ihrem jeweiligen Kontext erfährt, in einer einheitlichen Sprache, berufsgruppenübergreifend und systematisch zu erfassen und somit eine zielgerichtete Prävention und (individuelle) Rehabilitation multidisziplinär zu planen.
Der biomedizinische Krankheitsbegriff wird um die funktionellen Probleme und damit um die Auswirkungen einer Krankheit auf das Leben des Betroffenen erweitert. Daher kann die ICF als eine Ergänzung der ICD gesehen werden.
Die Konzepte der ICF
In ▶ Übersicht 2.1 sind die 4 Konzepte der ICF aufgelistet.
Übersicht 2.1 Konzepte der ICF
Kontextfaktoren
Körperfunktionen und -strukturen
Aktivitäten
Teilhabe an den Lebensbereichen
Nachfolgend werden die 4 Konzepte in ihren Grundzügen erläutert und ihre Einbindung in das bio-psycho-soziale Modell der ICF dargestellt. Der Rahmen dieses Buches erlaubt allerdings nur eine oberflächliche Darstellung, eine Vertiefung dieses Themas wird aufgrund der Aktualität und Tragweite im Bereich der Therapiewissenschaften jedoch empfohlen (z. B. Schuntermann 2007).
Kontextfaktoren
Die Kontextfaktoren werden unterteilt in Umweltfaktoren und personenbezogene Faktoren:
Die Umweltfaktoren stehen für die materielle, soziale und gesellschaftliche Welt, in der eine Person lebt.
Zu den personenbezogenen Faktoren zählen die Attribute einer Person, die nicht mit dem gesundheitlichen Problem (der Funktionsstörung) assoziiert sind, z. B. Alter, Geschlecht, Bildung, Sichtweisen, Einstellungen usw. Die personenbezogenen Faktoren werden aus verschiedenen, überwiegend ethischen Gründen nicht klassifiziert.
Umweltfaktoren und personenbezogene Faktoren werden in externe und interne sog. Förderfaktoren bzw. Barrieren eingeteilt, abhängig davon, ob deren Fehlen oder Vorhandensein sich positiv oder negativ auf die Funktionsfähigkeit auswirkt. Diese Unterscheidung lässt sich auf alle 3 folgenden Konzepte anwenden, die, falls normal und unbeeinträchtigt, in ihrer Gesamtheit eine funktionale Gesundheit (auch: Funktionsfähigkeit) ergeben.
Körperfunktionen und -strukturen
Die physiologischen Körperfunktionen umfassen den körperlichen, geistigen und seelischen Bereich. Als Körperstrukturen werden die anatomischen Anteile des Körpers bezeichnet.
Die Körperfunktionen und -strukturen sind i. d. R. eng miteinander verbunden, da bei einer Beeinträchtigung einer Körperfunktion häufig auch eine entsprechende Körperstruktur mitbetroffen ist. Die Beeinträchtigung/Schädigung einer Körperfunktion/-struktur kann permanent, vorübergehend, oder intermittierend sein, im Verlauf progressiv oder regressiv, in der Ausprägung geringfügig oder schwerwiegend.
Wichtig
Trotz Vorhandensein einer Dysfunktion muss die betroffene Person weder krank noch in ihren Aktivitäten oder der Teilhabe am Leben eingeschränkt sein.
Aktivitäten und Teilhabe
Die Konzepte der Aktivitäten und der Teilhabe beziehen sich auf die verschiedensten Lebensbereiche, z. B. Lernen, allgemeine Aufgaben und Anforderungen, Mobilität, Kommunikation oder Selbstversorgung. Abgesehen von allgemeinen Lebensbereichen können für jeden Patienten und seinen spezifischen Lebenshintergrund individuelle Lebensbereiche definiert werden, um z. B. die Ziele im Rahmen der Rehabilitation individuell anzupassen. In der Therapie liegt der Fokus naturgemäß auf den Beeinträchtigungen des Patienten, daher ist es für die Sichtweise des Patienten (wie der Patient sich selbst sieht) und die des Therapeuten (wie der Therapeut den Patienten sieht) von Bedeutung, neben den Beeinträchtigungen auch seine Fähigkeiten in den relevanten Lebensbereichen zu erfassen.
Patient und Therapeut sollten bedenken, dass die Ausführung einer Aktivität bestimmte Gegebenheiten voraussetzt. Um eine bestimmte Handlung ausführen oder eine bestimmte Leistung in einer realen Umgebung erbringen zu können,
müssen die entsprechenden Körperfunktionen/-strukturen ausgeprägt sein,
müssen die äußeren Umstände die Handlung ermöglichen (Umweltfaktoren) und
muss die Person eine entsprechende Handlungsbereitschaft und Motivation zeigen (personenbezogene Kontextfaktoren).
Ist eine dieser Voraussetzungen nicht gegeben, kommt die Handlung nicht zustande. Gerade wenn der Fokus – wie in der Physiotherapie – stark auf die Körperfunktion und -struktur ausgerichtet ist, erscheint es wichtig, die beiden letzteren Voraussetzungen miteinzubeziehen und möglichst von Beginn an zu hinterfragen. Aufgrund der Wichtigkeit finden sich Aktivität und Teilhabe als Hypothesenkategorie im Clinical Reasoning wieder (▶ Übersicht 2.9).
Das Modell der ICF
Im bio-psycho-sozialen Modell der ICF (◘ Abb. 2.2) sind die o. g. Konzepte vereint; das Modell ist somit ein hervorragendes Hilfsmittel, um die physiotherapeutische Befunderhebung und Behandlung zu strukturieren. Es hilft Therapeuten, die auf einen Begriff reduzierte Erkrankung (ICD-Diagnose) in ihren Auswirkungen auf die Körperfunktionen und -strukturen, die Aktivitäten und die Teilhabe in verschiedensten Lebensbereichen zu erfassen und die Wechselwirkungen zwischen den einzelnen Komponenten zu erkennen. Der häufig auf Körperstrukturen und -funktionen gerichtete Fokus wird um wichtige Bereiche erweitert, wodurch die Gesamtsituation des Patienten besser erfasst werden kann, und ferner das Befund- und Therapiespektrum erweitert und die Eigenreflexion verbessert werden können – vor allem dann, wenn der Therapiefortschritt ausbleibt.
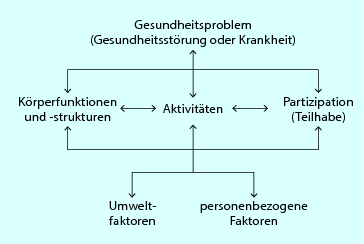
Abb. 2.2
ICF-Modell. Wechselwirkungen zwischen den Komponenten der ICF (WHO 2005 mit freundl. Genehmigung)
Für den Betroffenen reduziert das Modell die direkte Assoziation mit der Krankheit auf der Identitätsebene.
Die Konzepte der ICF werden bei manchen der in diesem Buch vorgestellten Untersuchungen und Behandlungen eingebunden. Neben dem direkten Feststellen und Erarbeiten von Beeinträchtigungen der Körperstrukturen/-funktionen, Aktivitäten und Teilhabe werden auch die personenbezogenen Faktoren und die Umweltfaktoren erfasst. Typische Befundsequenzen sind
die Sichtweise des Patienten,
das Erfassen der beitragenden Faktoren,
das Screening der Yellow Flags (▶ Abschn. 2.4.2, „Hypothesenorientiertes Denken und Handeln“) und
die Klärung der häuslichen Umstände, der familiären Situation und der Arbeitsplatzbedingungen.
Diese Befunde fließen dahingehend in die therapeutische Behandlung ein, als z. B. Heimprogramme besser an die Lebensumstände des Patienten angepasst werden, und auch die Aufklärung des Patienten, die Beratung, das Coaching oder die Arbeitsplatzberatung bewusst therapeutisch eingesetzt werden. Da der Patient seine Lebensumstände selbst am besten kennt, wird er so intensiv wie möglich in die Zielplanung und Therapiefindung miteinbezogen.
Praxistipp
Die ICF ist online auf den folgenden Internetseiten erhältlich:
2.3 Pathobiologische Mechanismen : Einführung und klinische Anwendbarkeit
G. Ulrike Tautenhahn, Thilo O. Kromer
Das Thema „pathobiologische Mechanismen“ – mit seinen komplexen theoretischen Hintergründen – wird in diesem Buch nur berührt. Ziel ist es, einen Überblick und vor allem klinisch relevantes Wissen zu vermitteln, um bei einem Patienten die dominanten Gewebe- und Schmerzmechanismen zu erkennen und die Therapie angepasst zu gestalten. Für ein umfassendes Verständnis zu dieser Thematik sei auf die Arbeiten aus der Physiologie und Schmerzgrundlagenforschung verwiesen. Empfehlenswert sind die Publikationen von Butler (2003), Gifford (1998, 2000, 2001), Main u. Spanswick (2000), Strong et al. (2002) sowie Butler u. Moseley (2003).
In der im Clinical Reasoning (▶ Abschn. 2.4) vorgestellten Kategorie unterteilt man die pathobiologischen Mechanismen in
Gewebemechanismen und
Schmerzmechanismen,
um eine tatsächliche Gewebeschädigung und die wirkenden Schmerzmechanismen unterscheiden zu können (Jones u. Rivett 2006).
In diesem Kapitel werden als Erstes die klinisch relevanten Grundlagen zu Schmerz und Wundheilung aufgezeigt, um die Schmerzmechanismen eines Patienten einordnen sowie die Art und Dosierung der Therapie einschätzen zu können. Im Weiteren werden die Schmerzmechanismen erklärt und die klinischen Präsentationen sowie die grundlegenden therapeutischen Herangehensweisen vorgestellt, mit dem Ziel, die Mustererkennung zu fördern und einen therapeutischen Leitfaden zu geben.
2.3.1 Wundheilung /Gewebemechanismen
Der physiologische Heilungsverlauf von Bindegewebe verläuft in Phasen, die jeweils mit einer Dosierungsempfehlung für die Therapie in ◘ Abb. 2.3 dargestellt sind. Die Dauer der Phasen ist individuell variabel und muss daher je nach persönlichem Befund und Clinical Reasoning angepasst werden. Einflussfaktoren wie Alter, Trainingszustand, Motivation, Nebenerkrankungen oder Faktoren wie z. B. inadäquate Immobilisation oder Bagatellisierung gilt es in der Anamnese zu erkennen. Für eine Vertiefung wird auf die entsprechende Literatur verwiesen (z. B. Dargel 1995; van Wingerden 1998; van den Berg u. Cabri 1999; de Morree 2001).
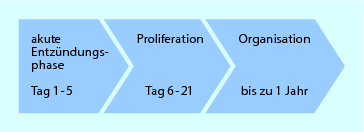
Abb. 2.3
Physiologischer Heilungsverlauf von Bindegewebe
Wundheilungsphasen
Phase 1: Akute Entzündungsphase
Dauer der Phase
Ca. 5–7 Tage, ab dem Zeitpunkt des Traumas bzw. der Operation.
Was passiert?
Im Wundgebiet kommt es zur Ausschüttung von Schmerz- und Entzündungsmediatoren, woraus Schmerzen, Hyperämie und Schwellung resultieren (vaskuläre Phase). Daraus ergibt sich i. d. R. eine Bewegungseinschränkung des Gelenks oder eine Funktionseinschränkung der betroffenen Struktur.
Makrophagen entfernen im Wundgebiet Gewebereste und sammeln Information über die Art der Gewebe; weiterhin locken sie Fibroblasten an (zelluläre Phase).
Konsequenz für die Therapie
Der Körper sollte die Möglichkeit haben, diese Phase in Ruhe zu durchlaufen. Therapeutische Maßnahmen sind
Ruhe,
Entspannung,
Immobilisation,
Kompression,
Lagerung,
evtl. entstauende Maßnahmen und
abhängig von der Verletzung evtl. leichte passive Bewegungen im schmerzfreien Bereich.
Phase 2: Proliferationsphase
Dauer der Phase
Bis etwa zum Ende der 3. Woche nach dem Trauma. Phase 2 entwickelt sich fließend aus Phase 1.
Was passiert?
Fibroblasten und einwachsende Kapillaren bilden ein Reparaturgewebe, das sog. Granulationsgewebe. Die Fibroblasten produzieren Hyaluronsäure, Proteoglykane und Kollagen Typ 3, das zunächst willkürlich angeordnet wird.
Im Laufe der 3. Woche kommt es zu einer Wundkontraktion durch die Myofibroblasten, wodurch sich das Wundgebiet verkleinert. Das entstehende Narbengewebe ist in dieser Phase noch sehr verletzlich. Typ-3-Kollagen wird progressiv in Typ-1-Kollagen umgebaut; hierzu ist vermehrt Sauerstoff notwendig. Um eine sinnvolle Anordnung der Fasern im Gewebe zu garantieren, sind progressive Belastung und Bewegung erforderlich. Die Fibroblasten werden durch Spannungs- und Ladungsveränderungen angeregt, die kollagenen Fasern entsprechend dieser Spannungskräfte einzubauen.
Konsequenz für die Therapie
Therapeutische Maßnahmen sind
aktives belastungsfreies oder teilbelastetes Bewegen,
durchblutungsfördernde und entstauende Maßnahmen.
Die Belastung ist Zone A (Fußzone) der Kraft-Verlängerungs-Kurve von kollagenem Bindegewebe anzupassen (◘ Abb. 2.4), was den manuellen Mobilisationsstufen 1 und 2 entspricht. Praktisch bedeutet dies, dass in einem weitgehend schmerz- und widerstandsfreien Bereich sowohl angulär als auch translatorisch bewegt werden soll.
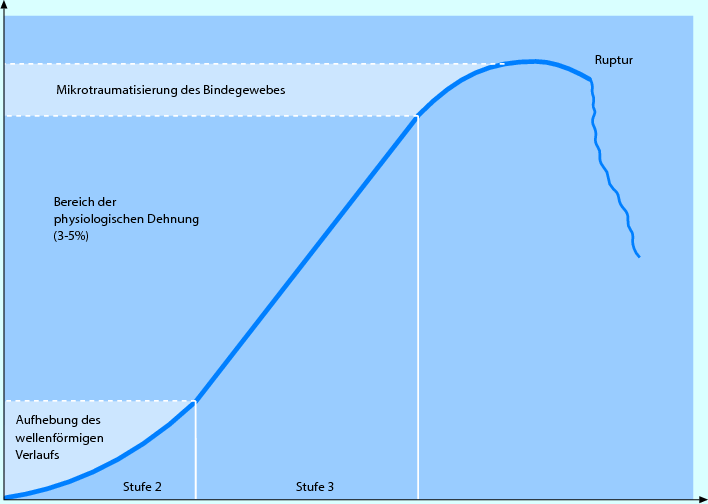
Abb. 2.4
Kraft-Verlängerungs-Diagramm von Bindegewebe Typ 1
Phase 3: Organisationsphase
Dauer der Phase
Anfang der 4. Woche bis zu einem Jahr oder länger.
Was passiert?
Das Gewebe gewinnt zunehmend an Stabilität und wird belastbarer.
Konsequenz für die Therapie
Therapeutische Maßnahme ist
progressive Belastungssteigerung ab der 4. Woche.
Die Belastung entspricht Mobilisationsstufe 3 (Zone B, ◘ Abb. 2.4), es kann also progressiv in den Widerstand gearbeitet werden. Trotzdem sollten vor allem zu Beginn dieser Phase auftretende Schmerzen als Limitierung respektiert werden.
Vorsicht
Zu Beginn von Phase 3 sollte das Gewebe nur so stark belastet werden, dass keine erneute Entzündungsreaktion provoziert wird (Retraumatisierung). Auch bei einem optimalen Heilungsverlauf kann nicht immer die ursprüngliche Belastbarkeit erreicht werden.
Immobilisationsfolgen
Werden Strukturen über einen längeren Zeitraum ruhig gestellt, oder hält der Patient selbst die verletzte Struktur aufgrund von Schmerzen vollständig oder teilweise ruhig, ergeben sich je nach Dauer unterschiedlich ausgeprägte Konsequenzen für das Gewebe, die nachfolgend stichpunktartig aufgeführt werden (Booth 1987; Kannus et al. 1992a, 1992b; Diekstall et al. 1995; Yasuda u. Hayashi 1999; Ahtikoski et al. 2001; Okita et al. 2004; Liu et al. 2011). Außerdem scheint sich auch eine nur kurzzeitige Ruhigstellung auf die Koordination und Haltung auszuwirken (Bolzoni et al. 2012). Dieser Umstand ist bei der initialen Mobilisation und Wiederbelastung zu berücksichtigen.
Wichtig
Die Dauer der (Teil-)Immobilisation ist mit ausschlaggebend dafür, wie schnell die Wiederbelastung erreicht werden kann.
Muskeln, Sehnen und Bänder
Der Knochen ist im Ansatzbereich geschwächt.
Nach 14 Tagen reduziert sich die Belastbarkeit des Muskel-Sehnen-Übergangs.
Nach 3 Wochen besteht eine um 50 % verminderte Kontaktzone von Muskel und Sehnengewebe.
Sehnen und Bänder
Die Kollagenfasern werden dünner, spalten sich in Längsrichtung auf und zeigen einen untypischen Verlauf.
Die Kapillarisierung (Durchblutung) reduziert sich.
Es kommt zu einer Abnahme von Proteoglykanen, Wasser, Kollagen und einer Degeneration der Fibrozyten, wodurch die Belastbarkeit der Sehne insgesamt abnimmt.
Gelenkkapsel
Die Festigkeit des Kapselgewebes nimmt ab, was sich auf die Steuerung des Gelenks während der Bewegungen auswirkt und zu Bewegungseinschränkungen führt.
Besteht die Immobilisation über lange Zeit, entstehen unerwünschte Crosslinks, und die Gelenkkapsel verliert ihre Flexibilität. Je nach Situation sind unterschiedliche Mobilisationstechniken indiziert.
Gelenkknorpel
Durch die Immobilisation kommt es zu einer Abnahme der Proteoglykanproduktion, einem Matrixverlust und zur Unterernährung der Chondrozyten. Auch der subchondrale Knochen zeigt atrophische Vorgänge.
Muskulatur
Schon nach wenigen Tagen kommt es zu einer deutlichen Atrophie. In den ersten 2 Wochen verliert der Muskel etwa die Hälfte an Muskelmasse, bei Ruhigstellung in verkürzter Position ist der Verlust ausgeprägter als bei Immobilisation in gedehnter Stellung.
Nach einiger Zeit passt sich die Muskulatur der Verkürzung bzw. Verlängerung an, bis die ursprüngliche Ruhespannung wieder erreicht ist.
Diese Vorgänge sind i. d. R. reversibel. Die Wiederherstellung beansprucht etwa die 2- bis 4fache Zeitdauer der Immobilisationsphase.
2.3.2 Schmerzmechanismen
Schmerzmechanismen beschreiben die verschiedenen Formen von
Input (Afferenz),
Verarbeitung und
Output (Efferenz),
die den körperlichen Beschwerden, Einschränkungen, Sichtweisen und dem Verhalten eines Patienten zugrunde liegen. ◘ Abb. 2.5a,b und ◘ Abb. 2.6 bieten eine Übersicht der verschiedenen Schmerzmechanismen und ihrer Wechselwirkungen. Bevor diese näher erläutert werden, wird zunächst der Begriff „Schmerz“ definiert.
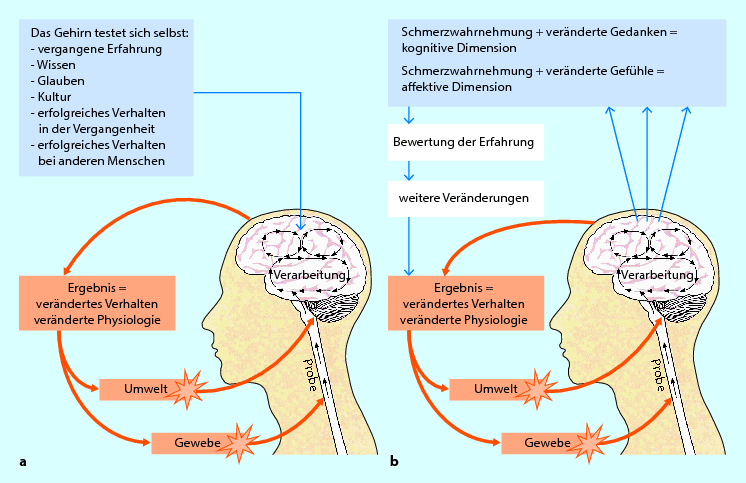
Abb. 2.5a,b
Modell des reifen Organismus bei Verletzung: a Das Gehirn testet sich selbst, b Die Situation wird durch die Eigentestung des Gehirns bewertet. Verhalten und Physiologie werden daraufhin verändert. (aus Gifford 2005 mit freundl. Genehmigung)
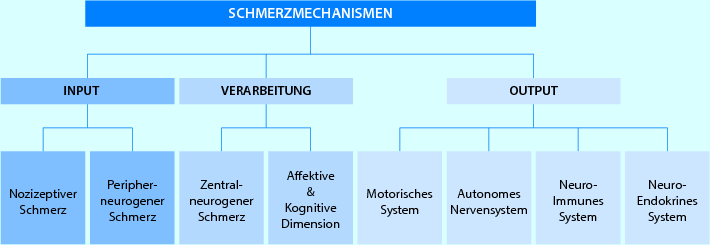
Abb. 2.6
Schmerzmechanismen: Übersicht über die verschiedenen Formen von Input- (Afferenz), Verarbeitungs- und Output-Mechanismen (Efferenz) (Tautenhahn mit freundl. Genehmigung)
Was ist Schmerz ?
Schmerz wird von der IASP als „ein unangenehmes Sinnes- und Gefühlserlebnis, das mit aktueller oder potenzieller Gewebeschädigung verknüpft ist oder mit Begriffen einer solchen Schädigung beschrieben wird“, definiert (Merskey u. Bogduk 1994).
Schmerz ist demnach eine individuelle Erfahrung und Interpretation einer bestimmten Körperempfindung physischer oder emotionaler Ursache, die in einem bestimmten Kontext auftritt. Schmerz hat also nicht immer etwas mit aktueller Verletzung und tatsächlicher Gewebeschädigung zu tun. Es ist eine subjektive Beschreibung, eine Interpretation einer unangenehmen Körperempfindung, die in einer bestimmten Intensität und Qualität spürbar ist. Die kognitive und emotionale (affektive) Bewertung eines z. B. starken Ziehens im Nacken (Körperempfindung) mag „Schmerz“ sein, wenn diese Körperempfindung gleichzeitig mit einer Unsicherheit oder Sorge behaftet ist. Um den Schmerz in seiner ganzen Dimension zu verstehen, müssen die pathobiologischen Mechanismen in größerem Zusammenhang gesehen werden, wobei das zentrale Nervensystem (ZNS) im Vordergrund steht und nicht die Veränderungen im Zielgewebe (Butler 2000; Gifford 2000).
Schmerz ist also eine komplexe Konstruktion, die aus vielen physischen und psychischen Komponenten besteht. Im Gehirn wird Schmerz als ein komplexes neuronales Aktivitätsmuster (sog. „neurotag“) repräsentiert, an dem unterschiedlichste Hirnareale und -zentren beteiligt sind und zu einer bestimmten Zeit in einem bestimmten Kontext gemeinsam aktiviert werden. Gemäß dem Hebb-Gesetz (Mahwah 2002) gilt, dass miteinander vernetzte Zellen gleichzeitig aktiv werden; daher kann eine Schmerzerfahrung aktiviert werden, wenn nur eine Komponente des entsprechenden Musters aktiviert wird. Das Gesetz sagt allerdings auch aus, dass Zellen, die gleichzeitig aktiviert werden, sich vernetzen.
Wichtig
Aus dem Hebb-Gesetz lässt sich eine enorme Chance für die Therapie ableiten: Verändert man einzelne Komponenten, kann man das gesamte Muster ändern, sofern der Patient dies versteht und erlernt.
Schmerzprozesse im bio-psycho-sozialen Kontext: Das Mature Organism Model (MOM)
Gifford (1998a, 1998b, 2000, 2005) entwickelte das Modell des reifen Organismus (Mature Organism Model, MOM) (◘ Abb. 2.5a,b). Es basiert auf den Grundlagen der Stressbiologie und betrachtet das Phänomen „Schmerz“ sowie die strukturellen Befunde eines Patienten mit neuromuskuloskeletalen Beschwerden aus einer mehrdimensionalen und bio-psycho-sozialen Perspektive. Es ist eines der aktuellen Denkmodelle, die helfen sollen, den Patienten als ein biologisches Wesen in seinem bio-psycho-sozialen Kontext zu sehen, indem neben dem Schmerz auch das Leid, die Behinderung, Einstellungen, das Krankheitserleben und -verhalten sowie der Einfluss des sozialen Umfelds berücksichtigt werden.
Nach dem MOM unterliegen Schmerzprozesse einem dynamischen, interaktiven Kreislauf. Man unterscheidet bei einem menschlichen Individuum innerhalb seines bio-psycho-sozialen Kontexts:
Input-Mechanismen,
Verarbeitungsmechanismen und
Output-Mechanismen.
Das MOM hilft Therapeuten, die komplexen Mechanismen des Phänomens „Schmerz“ verständlich zu machen und dient zudem als Aufklärungs- und Lernhilfe für Patienten. Alle Mechanismen wirken gleichzeitig auf das Individuum ein, sie überlappen sich und stehen permanent in Wechselbeziehung zueinander. Meist ist in einem Stadium eines Beschwerdebildes ein Mechanismus dominant, allerdings ändert sich diese Dominanz im Laufe des Genesungsprozesses. Ein Problem kann z. B. anfänglich dominant peripher-neurogen sein und im Laufe der Zeit zu einem dominant zentralen Problem werden, oder ein anfänglich dominant nozizeptiv-entzündliches Problem zu einem dominant nozizeptiv-ischämischen. Für einen effektiven Clinical Reasoning-Prozess (▶ Abschn. 2.4) ist es erforderlich, sich Wissen über die pathobiologischen Mechanismen und deren klinische Präsentationen anzueignen, um den aktuell dominanten Schmerzmechanismus eines Patienten zu erkennen und folglich eine adäquate und effektive Therapie durchzuführen.
Die verschiedenen Schmerzmechanismen haben unterschiedliche klinische Präsentationen (▶ Abschn. 2.3.3), sie können somit als klinische Muster (▶ Abschn. 2.4.3) kategorisiert und in den Clinical Reasoning-Prozess des Therapeuten integriert werden.
Schmerzmechanismen – eine Übersicht (◘ Abb. 2.6)
Input-Mechanismen
Die Input-Mechanismen „nozizeptiver Schmerz“ und „peripher-neurogener Schmerz“ sind Schmerzphänomene der peripheren Gewebe, die auf einer Sensibilisierung der peripheren Nozizeptoren und der peripheren neuralen Strukturen beruhen. Sie informieren den Menschen über das interne (körperliche/Gewebe) und das externe (Umwelt) Umfeld (Gifford 1998d; Butler 2000; Galea 2002).
Verarbeitungsmechanismen
Den Verarbeitungsmechanismen ordnet man die Verarbeitungsprozesse der Schmerzsignale im ZNS sowie die affektiven und kognitiven Faktoren zu. In der Befundaufnahme wird erforscht, ob die klinischen Zeichen auf eine adaptive oder maladaptive Verarbeitung im ZNS (zentrale Sensibilisierung) hinweisen. Obwohl diese Mechanismen pathobiologisch eng aneinander gekoppelt sind, ist es nach Ermessen der Autoren bei der Befundaufnahme und Behandlungsplanung sinnvoll, Affekt und Kognition von den strukturellen Anpassungen im ZNS getrennt zu betrachten und zu bewerten.
Ein maladaptiver Verarbeitungsmechanismus liegt dann vor, wenn die ursprüngliche periphere Verletzung längst geheilt ist, die Symptome aber weiter bestehen bleiben; sie basieren dann nicht mehr auf einem physiologischen Reiz-Reaktions-Verhältnis. Je mehr Anzeichen auf eine maladaptive Verarbeitung im ZNS hinweisen, desto höher ist die Wahrscheinlichkeit, dass die Symptomatik durch die Verarbeitungsmechanismen im ZNS bestimmt wird und nicht mehr dominant von einer Schädigung der peripheren Gewebe. Entsprechend sollte die Therapie ausgerichtet sein.
Nun ist Schmerz nicht nur ein physisches und sensorisches, sondern auch ein emotionales Erlebnis (Merskey u. Bogduk 1994), und dadurch wird die Schmerzverarbeitung stark von kognitiven und affektiven Faktoren beeinflusst:
Die affektive Dimension umfasst die Auswirkungen von Stimmungen oder Emotionen wie Angst, Hilflosigkeit, Ärger, Frustration und
die kognitive Dimension die Auswirkungen von Gedanken, Sichtweisen, Bewertungen, Überzeugungen, Wissen, Verständnis u. a. (s. MOM) (◘ Abb. 2.5b).
Das bedeutet, dass Schmerzen und Genesung durch alles beeinflusst werden, was der Patient über seine Schmerzen und Einschränkungen denkt und fühlt, wie er sie emotional erlebt (Gifford 1998c; Butler 2000; Main u. Booker 2000). So können maladaptive Gedanken sowie sich z. B. frustriert, ängstlich, ausgeliefert, hoffnungslos und hilflos fühlen zu einer verstärkten Schmerzwahrnehmung führen, welches in der Therapie erkannt und berücksichtigt werden muss.
Output-Mechanismen
Die Reaktionen auf die Input– und Verarbeitungsmechanismen werden als Output-Mechanismen bezeichnet und kommen im Wesentlichen über das motorische, das autonome, das neuroendokrine System und das Immunsystem zum Ausdruck (Gifford 1998c; Butler 2000). Die Output-Systeme sind alle miteinander verknüpft und stehen in Wechselwirkung zueinander. Sie können selbst Schmerzen und Dysfunktionen auslösen oder diese von anderen Systemen erhalten, und sie werden in starkem Maß von den Gedanken und Gefühlen beeinflusst.
Stay updated, free articles. Join our Telegram channel

Full access? Get Clinical Tree








